Pour aller plus loin dans la compréhension de la structure et de la
fonction des gènes, on doit disposer de moyens permettant de modifier la
séquence de l’ADN et d’analyser l’effet de ces changements sur la
fonction des gènes. Pour modifier la séquence de l’ADN, on utilise la
technique de mutagenèse in vitro de gènes clonés.
Il y a deux grands types de mutagenèse : la mutagenèse aléatoire et la mutagenèse dirigée. Nous ne présenterons ici que deux exemples de mutagenèse dirigée.
L’ADN matrice simple brin est préparé dans une souche d’E. coli déficiente en uracile déglycosidase (ung-), de manière à pouvoir contenir plusieurs résidus uracile à la place de thymine. L’oligonucléotide mutagène est apparié et est utilisé comme amorce pour la synthèse “in vitro” d’un brin complémentaire de la matrice. Cette synthèse est faite en présence des quatre désoxyribonucléotides normaux. Après ligature, les molécules hétéroduplexes sont introduites dans une souche ung+ d’E. CoU. Une fois dans la cellule, le brin de type sauvage (la matrice) est attaqué par l’uracile déglycosidase, qui provoque des coupures du brin d’ADN et ce brin est dégradé avant de pouvoir être répliqué. Comme le brin qui contient la mutation ne contient pas d’uracile, il n’est pas attaqué et il est répliqué normalement. On obtient ainsi essentiellement des plasmides mutants. Un séquençage permet de vérifier la présence de la mutation.
Il y a deux grands types de mutagenèse : la mutagenèse aléatoire et la mutagenèse dirigée. Nous ne présenterons ici que deux exemples de mutagenèse dirigée.

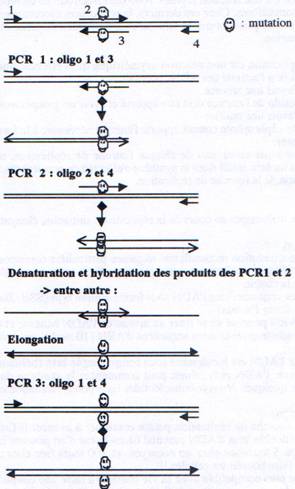
I Mutagenèse par extension enzymatique d’une amorce synthétique portant la mutation.
Dans cette méthode, on fabrique un oligonucléotide (par synthèse chimique) qui contient la mutation flanquée de 10 à 15 nucléotides de séquence non mutée. Cet oligonucléotide “mutagène” est hybridé à la séquence complémentaire sauvage présente dans l’ADN monocaténaire préparé à partir d’un clone dans un phage ou un phagemide. Il se forme donc un ADN hétéroduplexe. Cet oligonucléotide sert alors d’amorce pour la synthèse enzymatique d’ADN in vitro par une polymérase qui convertit l’ADN monocaténaire sauvage en une forme bicaténaire. L’ADN hétéroduplexe ainsi obtenu contient donc un brin sauvage et un brin muté. Cet ADN est ligaturé et transformé chez E. coli. Lors de la première réplication, on obtient donc un plasmide sauvage et un plasmide muté (qui se répliqueront à leur tour pour donner un mélange de plasmides sauvages et mutants). Pour discriminer ces deux types de plasmides (ou enrichir les cultures en clones mutants), un grand nombre de méthodes sont possibles : nous étudierons ici une de ces techniques : la mutagenèse dirigée selon Kunckel.L’ADN matrice simple brin est préparé dans une souche d’E. coli déficiente en uracile déglycosidase (ung-), de manière à pouvoir contenir plusieurs résidus uracile à la place de thymine. L’oligonucléotide mutagène est apparié et est utilisé comme amorce pour la synthèse “in vitro” d’un brin complémentaire de la matrice. Cette synthèse est faite en présence des quatre désoxyribonucléotides normaux. Après ligature, les molécules hétéroduplexes sont introduites dans une souche ung+ d’E. CoU. Une fois dans la cellule, le brin de type sauvage (la matrice) est attaqué par l’uracile déglycosidase, qui provoque des coupures du brin d’ADN et ce brin est dégradé avant de pouvoir être répliqué. Comme le brin qui contient la mutation ne contient pas d’uracile, il n’est pas attaqué et il est répliqué normalement. On obtient ainsi essentiellement des plasmides mutants. Un séquençage permet de vérifier la présence de la mutation.