Cet exemple d’organogenèse permet de mettre en évidence des interactions inductrices complexes entre les constituants d’un futur organe; des synthèses d’ARN et protéines spécifiques en résultent.
Description sommaire de la morphogenèse de l’œil
Fig. 87
Cet organe comprend des formations ectodermiques et mésodermiques la rétine et l’iris, expansions de la vésicule cérébrale, le cristallin et la cornée sont dérivés de l’épiderme céphalique. Les enveloppes de l’œil, choroïde et sclérotique, sont mésodermiques.Au stade bourgeon caudal, la vésicule antérieure du futur encéphale, le prosencéphale, forme latéralement deux expansions, les vésicules optiques, qui sont réunies entre elles par la bandelette chiasmatique. Ces vésicules s’étranglent au niveau de leurs pédoncules qui deviendront les nerfs optiques.
Elle se creuse en cupules dont la concavité est tournée vers l’extérieur. Les cupules sont formées de deux feuillets accolés, l’un se différencie en rétine sensorielle tournée vers l’épiderme, il est doublé vers l’intérieur par le second qui devient le feuillet pigmentaire. La périphérie de la cupule formera l’iris. Les cupules optiques s’appliquent contre l’ectoderme céphalique latéral qui s’épaissit en une ébauche, la placode cristallinienne à l’origine du cristallin. Cette placode s’invagine, se referme en vésicule cristallinienne et s’isole de l’épiderme. L’épiderme refermé au-dessus de la vésicule forme la cornée transparente. Les espaces entre cristallin et cupule optique sont envahis par du mésenchyme qui se différencie en corps vitré. Le globe oculaire acquiert sa rigidité grâce à la différenciation d’une enveloppe mésodermique à forte trame de collagène: la sclérotique, cartilagineuse ou porteuse d’éléments osseux dans certaines espèces (oiseaux).
Inductions
Les interactions actuellement connues entre les différents éléments formateurs de l’œil sont très nombreuses. Il n’en sera examiné que quelques-unes.1. La formation de deux vésicules optiques latérales est induite par le mésoderme précordal
A la fin de la gastrulation, l’ensemble de la plaque neurale antérieure possède des potentialités uniformes. Le toit de l’archentéron, sous la plaque neurale, est constitué par du mésoderme précordal qui va se dissocier ensuite pour former du mésenchyme céphalique. C’est sa présence qui induit le plancher du diencéphale à former des vésicules optiques, puis réduit. Ces potentialités à deux aires latérales de cette région. Si on fait l’ablation du mésoderme précordal, l’embryon sera anophtalme, c’est-à-dire dépourvu d’yeux ou sera cyclope et ne formera qu’une vésicule optique médiane. Les parois des vésicules optiques induites sont le siège d’une activité mitotique accrue et une certaine turgescence interne du tube neural favorise leur expansion.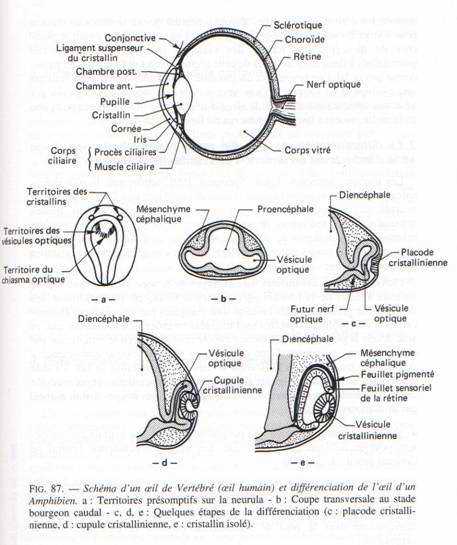
2. La différenciation du cristallin est le résultat le l’action d’une série d’inducteurs en direction de l’épiderme céphalique
Les travaux antérieurs, depuis Spemann, 1901, attribuaient le rôle inducteur essentiel à la vésicule optique et considéraient que tout l’ectoderme de la neurula était compétent pour former un cristallin. Ces conclusions, basées souvent sur des expériences de transplantation et de greffe, ne peuvent être retenues. Les techniques de marquage des tissus du donneur et du receveur ainsi que les méthodes purement morphologiques pour détecter un cristallin étaient insuffisantes.Plus récemment, des travaux sur l’embryon de xénope entre les stades de la gastrula âgée et de la neurula âgée (Henry et Grainger, 1990) utilisent des donneurs de greffes dont les cellules sont marquées par un marqueur fluorescent non diffusible. Les greffes sont réalisées en enlevant l’ectoderme qui, in situ, donne la placode cristallinienne puis le cristallin, et en le remplaçant par de l’ectoderme provenant d’une autre région dont on teste la compétence à donner du cristallin. L’identification d’ébauche de cristallin se fait à l’aide d’anticorps dirigés contre les cristallines, protéines spécifiques et précoces du cristallin, identifiées par immunoélectrophorèse ou, sur coupes histologiques, par immunohistochimie.
• a) L’ectoderme céphalique à la périphérie de la plaque neurale est compétent pour se différencier en cristallin. Les greffes d’ectoderme ventral ne donnent jamais de cristallin.
• b) Cette compétence de l’ectoderme est acquise sous l’effet de premières inductions qui proviennent essentiellement de la plaque neurale céphalique (à un moindre degré, également de l’endoderme céphalique) et qui ont diffusé latéralement dans le plan de l’ectoderme pendant la gastrulation et la neurulation.
• c) Quand les vésicules optiques se forment, elles induisent, à elles seules de petites formations de cristallin ; si on fait l’ablation des vésicules, le cristallin ne se différencie pas.
• d) Le mésenchyme céphalique, combiné à du tissu neural augmente la capacité de l’ectoderme compétent à former un cristallin, mais, à lui seul, il n’est pas inducteur.
Il existe cependant, d’une espèce à l’autre, des variations de l’importance relative de ces différents inducteurs, ce qui contribue à la diversité des résultats.
3. Différenciation de la vésicule optique
La présence de mésenchyme céphalique et celle de l’ectoderme céphalique superficiel induit à former une placode cristallinienne sont nécessaires à la croissance de la vésicule optique et à sa différenciation. En leur absence, la vésicule ne forme qu’un épithélium pigmenté et ne se creuse pas en une cupule. Dans les conditions normales, le cristallin induit à se différencier par la vésicule optique rétroagit sur celle-ci en provoquant la différenciation du feuillet interne de la vésicule optique en rétine sensorielle : la différenciation se manifeste par un accroissement de l’activité mitotique dans la future rétine sensorielle qui a pu être détectée par histo-autoradiographie après injection de thymidine 3H. Le feuillet s’épaissit, les cellules filles migrent pour se placer à des niveaux qui correspondent aux différentes couches de la future rétine. La différenciation progressive qui suit s’achève par celle des cellules visuelles. Le feuillet épithélial externe de la cupule rétinienne se pigmente en présence du mésenchyme céphalique. Cette différenciation reste un certain temps labile. On peut en effet, expérimentalement, transplanter les deux couches de la cupule optique non différenciée au contact d’une vésicule cristallinienne, en les retournant, et inverser ainsi la destinée de chaque feuillet: ce qui devait devenir sensoriel devenant rétine pigmentée, et réciproquement. L’environnement tissulaire est donc fondamental dans l’orientation de la différenciation.4. Différenciation de la cornée transparente
L’ectoderme situé au-dessus du cristallin devient la cornée transparente. Elle est formée de cellules transparentes avec des espaces interstitiels réduits.Elle ne contient pas de cellule glandulaire. Le rayon de courbure de la cornée transparente est très précis. Il est plus tard doublé d’un mésenchyme sous épithélial et d’une trame régulière de collagène élaborée par des fibroblastes. Cette différenciation peut être provoquée sur n’importe quel épiderme compétent de neurula au contact d’un cristallin ou d’un fragment de rétine. L’induction doit alors être permanente pour maintenir la transparence; après ablation du cristallin, la cornée s’opacifie.
La sclérotique se différencie dans le mésenchyme autour de la cupule optique. De couleur blanche, elle réfléchit totalement la lumière. Riche en collagène et parfois en cartilage ou tissu osseux, elle est précocement déterminée mais on ne connaît pas son tissu inducteur.
Conclusion
Cet exemple, exposé ici de façon simplifiée, montre que, dans toute organogenèse, les interactions tissulaires ou inductions sont réciproques et se succèdent suivant un programme parfaitement réglé. Là aussi des anomalies dans le déroulement des inductions peuvent déclencher des malformations, comme la cyclopie ou l’anophtalmie.Les interactions tissulaires sont tout à fait générales, on les a mises en évidence par exemple dans le cas de la formation du foie, du poumon, du rein, du pancréas, des dents, des plumes, etc. On y retrouve toujours une dualité épithélium et mésenchyme et le rôle de chacun d’eux a pu parfois être précisé en pratiquant des recombinaisons, en culture in vitro, entre épithélium d’une origine et mésenchyme de l’autre. Les résultats sont très variables suivant les protagonistes de l’association. Le mésenchyme joue le rôle inducteur dans la différenciation des plumes; c’est l’épithélium qui a de fortes capacités d’autodifférenciation dans le pancréas, avec un mésenchyme apparemment passif; les deux composants ont une influence égale dans la différenciation d’une dent. Ces quelques exemples montrent la grande délicatesse de l’équilibre qui aboutit à une différenciation.
L’œil fournit par ailleurs un excellent exemple pour étudier les effets de l’induction sur les synthèses d’ARN et de protéines spécifiques.
