Structure de l’oeuf d’oiseau
Organisation de l’œuf et de ses enveloppes
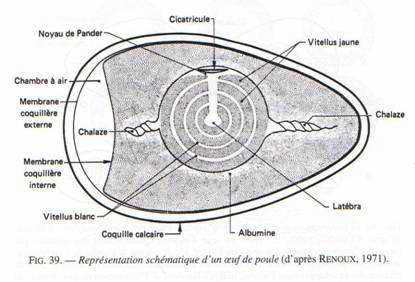
Fig. 39.
C’est un oeuf télolécithe qui se caractérise par une accumulation tardive de réserves. La croissance de l’ovocyte se déroule lentement jusqu’à une semaine environ avant l’ovulation; dans une seconde phase qui dure 6 à7 jours chez la poule, l’œuf passe de 0,2 à 16 grammes environ. Il se dépose un vitellus dont les éléments sont élaborés dans le foie. Le jour, un vitellus jaune se forme, plus riche en graisse et en pigment que le vitellus nocturne qui est blanc. La latebra est la masse centrale du vitellus anciennement formé, le col et le noyau de Pander marquent le chemin de migration de la cicatricule vers la surface du cytoplasme pendant la croissance de l’œuf. La cicatricule, de 3 mm de diamètre, marque le pôle animal de l’œuf; constituée de cytoplasme sans réserves, elle seule se segmentera.Une membrane vitelline constitue la membrane primaire périovulaire. S’il y a eu fécondation, celle-ci se produit au niveau de la trompe de l’oviducte. Des enveloppes secondaires se déposent ensuite pendant le transit de l’œuf dans l’oviducte. Le blanc ou albumine se forme en trois heures dans une portion égale à la moitié de la longueur de l’oviducte (le magnum), puis la membrane coquillière se dépose dans l’isthme en une heure. Le blanc s’enrichit en eau dans l’utérus où son volume double; la coquille se constitue en 22 heures.
L’œuf d’Oiseau est composé d’eau, 65% ; protéines, 12% ; graisses, 10% ; calcite, 10%; divers, 2,5%.
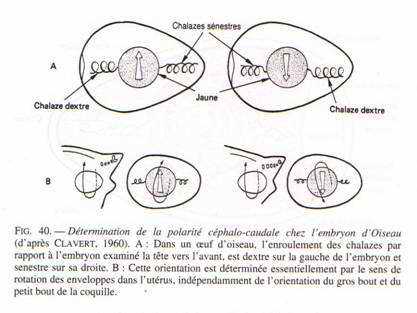
Acquisition de l’orientation de l’embryon.
L’axe antéro-postérieur de l’embryon se fixe au cours du séjour de l’œuf dans l’utérus (fig. 40) après formation des membranes et de la coquille. Les enveloppes de l’œuf subissent un mouvement de rotation qui se matérialise par la torsion d’une partie de l’enveloppe albumineuse, les chalazes, qui se fixent à la membrane coquillière à la droite de l’embryon, la chalaze est senestre, à sa gauche elle est dextre. C’est la pesanteur et le sens de rotation qui interviennent dans cette détermination. La démonstration en a été apportée en agissant sur des oeufs obtenus précocement par pression au niveau de l’utérus où ils n’avaient séjourné que 10 heures. L’axe antéro-postérieur n’est pas encore définitivement fixé et, suivant la position qu’on fait adopter aux oeufs en expérience tandis qu’ils tournent artificiellement, on modifie sa direction.Dans les conditions normales, le disque embryonnaire, ou blastodisque adopte une position dans l’espace telle que l’axe de l’embryon est perpendiculaire au grand axe de la coquille, la tête étant tournée dans le sens de la rotation de l’œuf. L’acquisition de la symétrie bilatérale n’est irréversible qu’après un temps de transit dans l’oviducte de 14 à 16 heures; ce temps correspond à un stade de la segmentation où l’hypoblaste a progressé dans la cavité de segmentation, le sens de cette progression ayant un effet déterminant sur l’orientation des territoires ecto-mésodermiques, comme on le verra ultérieurement. Le plan dorso-ventral de l’animal correspond au gradient vitellin, la partie dorsale étant à la surface du disque embryonnaire.
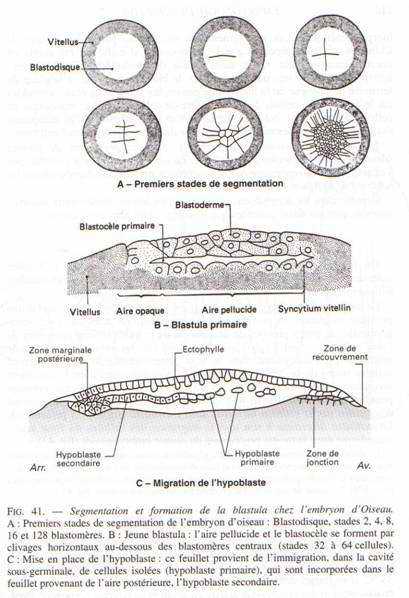
Segmentation.
Fig. 41.
C’est une segmentation partielle qui n’intéresse que le disque germinatif de 3 mm de diamètre environ. Son cytoplasme est dépourvu de réserves et contient le noyau de fécondation. La segmentation se produit dans l’oviducte et commence 5 heures après la fécondation chez l’embryon de poulet, elle est achevée au bout de 24 heures. La blastula comporte alors quelques dizaines de milliers de cellules.Les premiers blastomères, jusqu’au stade 16 cellules, n’ont pas de membrane plasmique inférieure (fig. 41a). Le blastodisque en segmentation ou blastoderme compte 8 blastomères centraux à limites nettes et 8 blastomères périphériques dont les limites avec le vitellus sont peu distinctes. Aux stades 32 et 64, les blastomères centraux acquièrent une limite inférieure. Plusieurs assises cellulaires se mettent en place par multiplication des cellules du disque central. Une cavité se creuse entre celles-ci et le vitellus sous-jacent (fig. 41b). On distingue alors plusieurs régions dans le blastoderme. Au centre, l’aire pellucide avec les cellules au-dessus de la cavité de segmentation. A la périphérie. L’aire opaque comprend 3 zones : la zone de recouvrement, où les mitoses sont actives, avec des blastomères bien individualisés au Contact du vitellus, le rempart germinatif qui est une zone profonde dont les blastomères sont individualisés, la zone de jonction qui est une assise profonde, sans limites nettes avec le vitellus et qui constitue le syncytium vitellin.
Gastrulation.
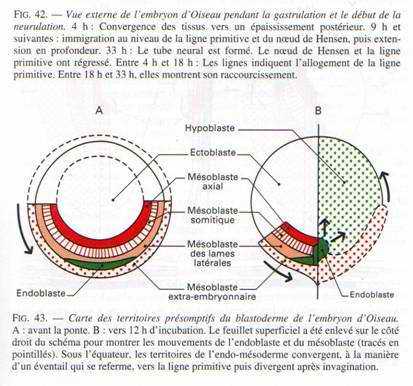
Différentes méthodes ont été utilisées pour établir des cartes des territoires présomptifs de la blastula des Oiseaux et analyser les mouvements morphogénétiques. Les mouvements de très petites particules d’encre de Chine ou carbone déposées sur le blastoderme d’œufs ont été suivis en microcinématographie. On a aussi utilisé des techniques plus précises transplantations de très petits territoires de blastula de caille, à la place du territoire homologue de la blastula de poulet, les transplants étant repérables car le noyau de la cellule de caille diffère de celui du poulet; marquages de cellules à l’aide d’un colorant fluorescent et non diffusible. Ces marqueurs ont permis de suivre les migrations et de localiser ces cellules dans l’embryon.Les cartes des territoires présomptifs obtenues présentent de légères variantes suivant la technique employée. La carte de la figure 43, établie par Vakaet (1985), ne représente pas le neuroblaste présomptif; il apparaît sur les schémas de la figure 42, établis d’après d’autres travaux.
Comme chez les Amphibiens (cf. p. 103), les limites réelles entre les territoires ne sont pas aussi tranchées que semblent l’indiquer les schémas.
Mise en place de l’hypoblaste
Un feuillet interne, l’entophylle ou hypoblaste, va doubler le feuillet externe, l’ectophylle ou épiblaste qui s’étend et s’amincit. Ces deux feuillets délimitent un blastocœle homologue du blastocœle des Amphibiens.Le mode de formation de l’hypoblaste est encore discuté. Il provient d’une première migration en profondeur (polyinvagination), dans la cavité sous-germinale, de petits groupes de cellules ou de cellules isolées provenant de l’aire pellucide, c’est l’hypoblaste primaire; elle est suivie d’une seconde migration plus importante, dans le sens postéro-antérieur, d’un feuillet de cellules issues de la partie postérieure de l’aire pellucide, c’est l’hypoblaste secondaire qui rejoint et englobe les îlots de cellules de l’hypoblaste primaire pour former l’hypoblaste (fig. 41). La direction de cette dernière migration est déterminée par la rotation de l’œuf dans l’oviducte (fig. 40), la présence de l’hypoblaste détermine à son tour la migration des cellules du futur endomésoderme dans la moitié postérieure du disque embryonnaire (fig. 43).
Le disque embryonnaire comprendrait, répartis en zones concentriques, des territoires ayant des potentialités endodermiques et mésodermiques, qui ne s’expriment pas naturellement dans la moitié antérieure, mais seulement sous certaines conditions expérimentales. La limite de ces zones est évoquée par un tracé en pointillé fig. 43 A.
Formation de la ligne primitive
La symétrisation de l’œuf a lieu environ 5 heures avant la ponte et les territoires de l’endoblaste se condensent à l’arrière du blastoderme (fig. 43 A). Dans les premières heures de l’incubation qui, chez la poule, dure 21 jours à 38 0C, il se forme, dans la zone marginale postérieure de l’aire pellucide, un épaississement qui progresse d’arrière en avant et se referme comme un éventail dont l’extrémité serait au centre du blastoderme, et les bras aux limites extrêmes du mésoblaste présomptif (fig. 43, 44). Cet épaississement résulte de la migration, vers l’arrière du disque embryonnaire, de certaines cellules dispersées dans l’épiblaste. Ces cellules dont la membrane contient un acide glycuronique sulfaté particulier seraient guidées (chimiotactisme) par une substance émise par l’hypoblaste et dont la concentration est maximale dans la zone marginale postérieure. Les cellules qui s’enfoncent alors sous l’épiblaste formeront l’endoblaste et du mésoblaste (Stern, 1991). Tandis que le blastoderme s’allonge dans le sens antéro-postérieur, cet épaississement en éventail s’allonge également et se referme en une ligne primitive avec un sillon médian, trace de l’immigration en profondeur des cellules du mésoblaste; elle sera terminée par un renflement antérieur, le nœud de Hensen. Son développement est à son maximum après 18 heures d’incubation. Au fur et à mesure que la gastrulation se déroule, cette ligne régresse et le prolongement céphalique constitué par le mésoderme axial invaginé devient visible par transparence.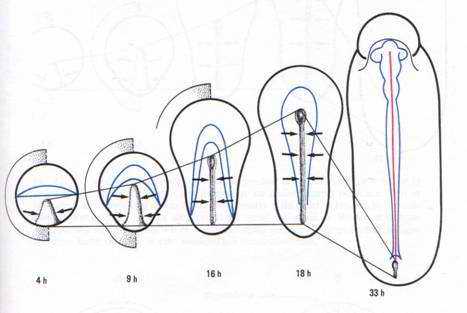
Mise en place de l’endoblaste et du mésoblaste
L’embryon se développe uniquement à partir de l’épiblaste de la blastula. Les tissus de l’aire opaque constituent l’ectoderme extra-embryonnaire dont les cellules du front migrent activement à la surface du jaune, prolifèrent et tendent à l’envelopper par épibolie. Elles sont à l’origine de l’ectoderme des annexes. Ce feuillet est doublé intérieurement par l’expansion du mésoderme extra-embryonnaire.Les mouvements gastruléens peuvent se décomposer comme chez les Amphibiens (fig. 44) convergence des cellules du blastoderme vers la zone de formation de la ligne primitive; immigration en profondeur des cellules de l’endoblaste et du mésoblaste au niveau de la ligne primitive, ces cellules migrant isolément ou sous la forme d’un mésenchyme lâche; divergence du mésoblaste extra-embryonnaire et des lames latérales de part et d’ autre de la ligne primitive (les cellules de l’endoblaste et du mésoblaste axial migrent vers l’avant au niveau du nœud de Hensen et restent dans la zone médiane) ; les mouvement d’élongation de l’embryon se poursuivent pendant toute la gastrulation ; celle-ci ne s’achève, à l’arrière de l’embryon, qu’avec la disparition totale de la ligne primitive, tandis que la neurulation est déjà terminée dans la région antérieure.
- Les cellules de l’endoblaste qui migrent les premières, à partir de la 10ème heure, au niveau du nœud de Hensen, se dirigent vers l’avant (fig. 44); elles écartent l’hypoblaste, le remplaçant dans l’axe antéro-postérieur de l’embryon et formant l’ébauche du tube digestif antérieur; l’hypoblaste, repoussé dans l’aire extra-embryonnaire, forme vers l’avant et latéralement le croissant germinal contenant les cellules germinales primordiales (v. p. 264); il va prolonger l’endoblaste dans l’aire extra-embryonnaire. De l’endoblaste migre aussi latéralement, de part et d’autre de la ligne primitive; à l’arrière de l’aire pellucide, de l’endoblaste de jonction a une destinée extra-embryonnaire.
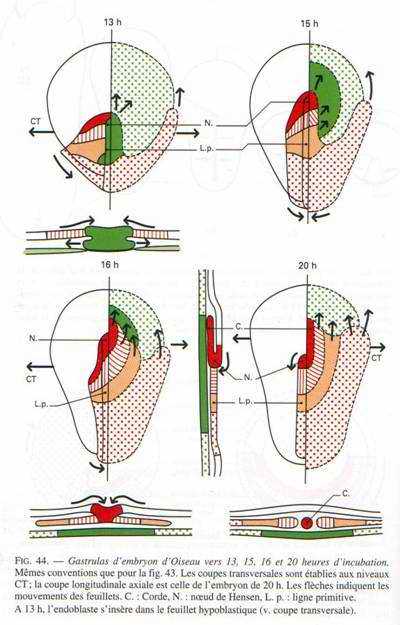
- La migration du mésoblaste débute vers la 14ème heure, tous ces tissus se mettent en place dans le blastocœle, entre l’épiblaste et le feuillet interne (fig. 44). Elle commence dans la moitié postérieure de la ligne primitive par l’invagination et l’extension vers l’avant du mésoderme extra-embryonnaire. Lorsque commence le recul de la ligne primitive, le mésoblaste axial, précordal et cordal, s’invagine au niveau du nœud de Hensen à la suite de l’endoblaste et migre dans l’axe de l’embryon ; la corde forme un axe dense, visible par transparence, le prolongement céphalique. De part et d’autre du nœud de Hensen et de la moitié antérieure de la ligne primitive migrent successivement le mésoblaste des lames latérales et celui des pièces intermédiaires qui divergent vers l’avant et latéralement; le mésoderme des premiers somites s’installe en dernier lieu, sans s’étaler.
- Fin de la gastrulation: vers la 20ème heure d’incubation, il ne reste en surface que le l’ectoblaste, à l’exception d’une zone de prolifération intense au niveau du nœud de Hensen, où continuent à se former du neuroblaste et de la corde, et au niveau des parois de la ligne primitive, où se forment les mésodermes latéral et somitique de la partie postérieure de l’embryon.
- L’ectoblaste comprend le neuroblaste qui s’étend dans l’axe de l’embryon, au dessus de la zone de migration du mésoblaste cordal et précordal (fig. 42); le reste de la surface de l’aire pellucide correspond à l’épiblaste. Le mouvement de recul du nœud de Hensen et de la ligne primitive ne s’achève que vers la 48ème heure d’incubation, alors que l’organogenèse a déjà commencé.
Neurulation
Fig. 45-46
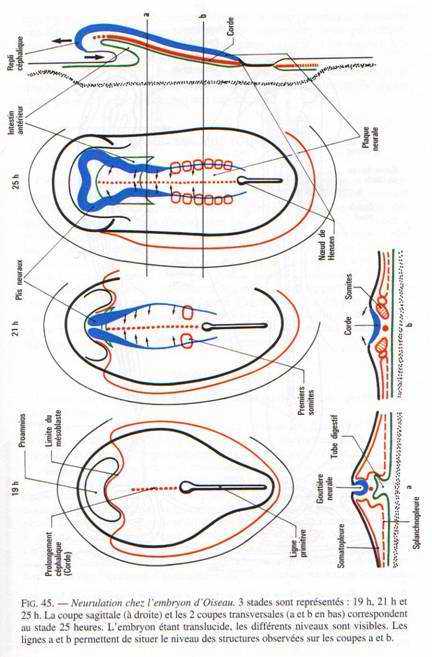
Les plis neuraux apparaissent après 20-21 heures d’incubation, de part et d’autre du neuroblaste, délimitant la plaque neurale et se rencontrent dans l’axe médian au niveau du cerveau moyen après 26 heures. La fermeture progresse vers l’avant, isolant le cerveau antérieur vers 30-33 heures. La fermeture du tube neural s’achève au niveau caudal après 44 heures d’incubation.L’embryon commence à se détacher de la masse de l’œuf: la région antérieure se soulève au-dessus du blastoderme. Il se forme alors un repli céphalique ectodermique ventral qui entraîne la délimitation de l’intestin antérieur en repliant avec lui l’endoderme sous-jacent. Le même pincement délimitera plus tard l’intestin postérieur; les 2 ébauches se rencontrent au bout de 4 jours; la communication entre le tube digestif et le vitellus est alors réduite à un simple tube, le pédicule vitellin.
Les somites se différencient à partir de la 20ème heure d’incubation, la métamérisation découpant le mésoblaste somitique à raison de 1 paire par heure d’incubation. Les pièces intermédiaires s’individualisent. Les lames latérales se rejoignent ventralement sous le pharynx en avant de la zone des somites. Des ébauches paires qui s’en détachent fusionnent pour former le tube cardiaque.
Les lames latérales extra-embryonnaires s’insinuent dans l’aire opaque à la périphérie du blastoderme. C’est dans la paroi de leur splanchnopleure que se différencient les îlots sanguins avec les premières cellules sanguines. Ces îlots se ramifient et fusionnent en une aire vasculaire extra-embryonnaire. Les lames latérales extra-embryonnaires entreront dans la constitution des annexes embryonnaires.
La ligne primitive continue de reculer et de se raccourcir en direction caudale, tandis que la gastrulation se poursuit. Elle se trouve finalement enserrée dans une région légèrement déprimée, le sinus rhomboïdal, délimitée vers l’avant par les plis neuraux; cette région contient des tissus qui complèteront en surface le tube nerveux, en profondeur, la corde et les somites. Les plis neuraux n’achèvent de se rejoindre qu’au bout de 44 heures.
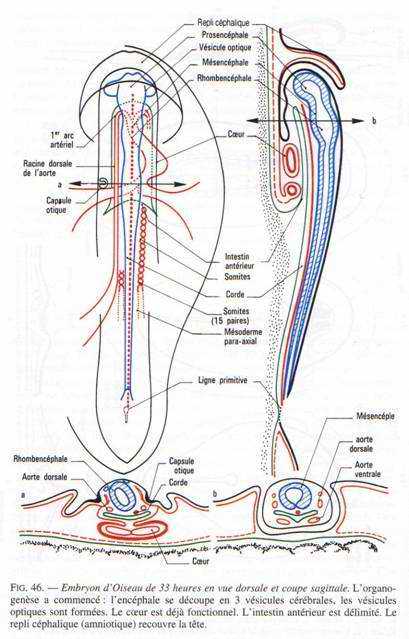
Au bout de 33 heures, l’embryon se tord dans sa partie antérieure et se couche sur la gauche, tandis que les vésicules cérébrales et la région cardiaque se différencient et croissent rapidement.
Annexes embryonnaires
Fig. 47 et 48
Ce sont des formations d’origine ectodermique, mésodermique et endodermique qui se développent hors du corps de l’embryon proprement dit, assurent sa protection, l’absorption des réserves, la respiration, l’élimination des déchets. Vers 2O-24 heures d’incubation, le corps de l’embryon commence à se distinguer des tissus périphériques; les plis antérieurs, plis postérieurs et plis latéraux le soulèvent et l’isolent de la masse vitelline. Pendant ce temps, les feuillets embryonnaires s’étendent hors du corps de l’embryon et vont continuer à former les annexes : vésicule vitelline, amnios et allantoïde. Celles-ci s’individualisent tandis que l’isolement de l’embryon par rapport à la masse de l’œuf s’accentue rapidement. A 96 heures d’incubation, il n’est plus relié à la vésicule vitelline et à l’allantoïde que par les pédicules vitellins et allantoïdiens. La cavité amniotique l’entoure alors complètement. Ces mêmes annexes vont se retrouver au cours de l’ontogenèse des Mammifères.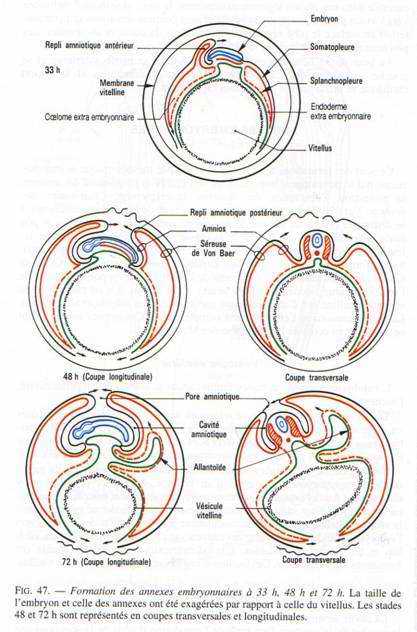
Vésicule vitelline
L’endoblaste n’est qu’un mince feuillet aplati au-dessus d’une petite cavité, l’archentéron.Tandis que l’archentéron en se refermant vers l’avant, l’arrière et les côtés va donner le tube digestif de l’embryon, les tissus endodermiques et l’hypoblaste qui le prolongent vont proliférer hors de l’embryon, s’étaler à la surface du jaune, tendre à l’englober et à constituer la vésicule vitelline (Fig. 47).
Cet endoderme extra-embryonnaire est suivi dans sa croissance par le mésoderme extra-embryonnaire, creusé d’un cœlome extra-embryonnaire; on y distingue un feuillet interne ou splanchnopleure et un feuillet externe ou somatopleure. Des vaisseaux sanguins se différencient dans le mésoderme splanchnique:
La vésicule vitelline est richement vascularisée pour le transfert des réserves vers l’embryon. L’endoderme sécrète des enzymes qui fragmentent les granules vitellins et les rendent assimilables. L’ectoderme extra-embryonnaire double ces formations vers l’extérieur. Ces feuillets n’englobent jamais totalement le vitellus.
Cavité amniotique
La cavité amniotique se forme à partir de 30 à 33 heures d’incubation. C’est le résultat de la soudure d’un repli de l’ectoderme doublé de la somatopleure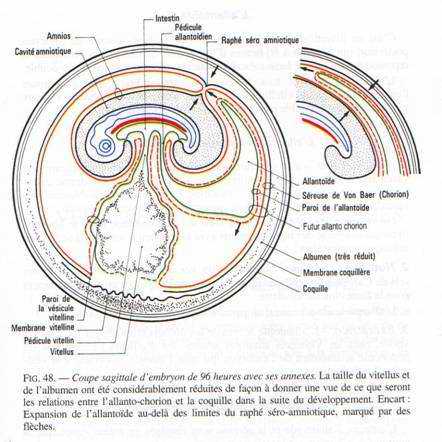
L ‘allantoïde
C’est un diverticule endodermique, issu de la face ventrale de l’intestin postérieur, qui apparaît à 60 heures d’incubation. Sa croissance est rapide. Il repousse devant lui une lame mésodermique, la splanchnopleure, qui le double.L’allantoïde envahit tout le cœlome extra-embryonnaire et entoure l’amnios et la vésicule vitelline en refoulant l’albumen. L’embryon à 14 jours sera entouré d’une double enveloppe l’amnios et l’allantoïde.
L ‘allantoïde a plusieurs fonctions.
- 1. Respiratoire. — Sa doublure mésodermique, ou splanchnopleure, est vascularisée, elle s’applique contre la séreuse (c’est-à-dire ectoderme extra-embryonnaire + somatopleure) et l’ensemble formera un allanto-chorion, très vascularisé où se feront les échanges respiratoires à travers la coquille.
- On retrouve les mêmes feuillets chez les Mammifères, dans le placenta fœtal qui contracte des rapports étroits avec la muqueuse utérine où se font les échanges respiratoires.
- 2. Nutritive. — L’allanto-chorion est un site d’absorption d’une partie des sels de Ca2+ de la coquille à laquelle il est accolé; ils sont utilisés notamment pour la formation du squelette.
- L’allantoïde absorbe aussi en partie l’albumen, ou blanc de l’œuf.
- 3. Excrétrice. — L’allantoïde accumule les déchets éliminés par les reins (la vessie, chez les Vertébrés amniotes adultes, est d’ailleurs l’homologue du pédoncule allantoïdien de l’embryon qui relie l’intestin postérieur à la vésicule allantoïdienne).
Destinée des annexes après l’éclosion
L’amnios, l’allantoïde et la séreuse sont éliminés en même temps que la coquille. L’albumen a été totalement utilisé.Il reste 1/3 à 1/5 du jaune. Il se rétracte à l’intérieur de la cavité abdominale de l’embryon et se trouve incorporé à l’intestin moyen; il sera utilisé dans les deux premières journées de la vie libre.
Conclusion
Cette description des premiers stades du développement montre que, à partir d’un plan d’organisation différent de celui de l’œuf d’Amphibien, on aboutit à de grandes similitudes et à des homologies parfaites entre l’organogenèse des Oiseaux et celle des Amphibiens.Une différence essentielle est liée au mode de segmentation dû au vitellus et au développement d’organes provisoires, les annexes, qui protègent l’embryon et lui permettent d’utiliser les réserves vitellines qui restent externes au corps de l’embryon proprement dit.
