Introduction.
Le système immunitaire a deux missions essentielles :
- La surveillance permanente de tout l’organisme afin de détecter le plus rapidement possible un agent étranger (Ag), et,
- Combattre l’agresseur et l’éliminer.
La surveillance est le fait de deux catégories de cellules: les leucocytes sentinelles (fixes) et les leucocytes patrouilleurs (circulants).
Les leucocytes fixes: ils sont disséminés dans tout l’organisme mais préférentiellement concentrés aux frontières de l’organisme. Par exemple, on trouve les cellules dendritiques au niveau de la peau (les cellules de Langerhans), les macrophages tissulaires résidants sont abondants au niveau des muqueuses, les cellules de Kuppfer (ou macrophages spléniques) sont au niveau du foie et préviennent d’une entrée par la voie sanguine par l’intermédiaire du système porte. On peut également considérer les polynucléaires neutrophiles qui adhèrent à la paroi des capillaires sanguins (c’est le secteur marginal des polynucléaires neutrophiles).
Le leucocytes circulants: ils se déplacent en permanence dans le système sanguin et lymphatique. Il s’agit surtout des macrophages, des polynucléaires neutrophiles, des monocytes sanguins (en grand nombre) mais aussi d’une catégorie de lymphocytes appelée «naïfs» car ils n’ont jamais été au contact de l’antigène. Ils circulent en permanence, gagnent les organes périphériques, pénètrent dans les structures particulières (les HEV: veinules à endothélium haut).
Ces cellules retournent dans le sang par des vaisseaux lymphatiques efférents, puis dans le canal thoracique, puis dans la veine sous-clavière gauche.
C’est grâce à cette circulation, et avec une spécificité donnée qu’ils peuvent découvrir un antigène et déclencher la réponse immunitaire spécifique.
Concernant la deuxième mission, le système immunitaire va être alerté par tout un système de signaux de la présence et de la localisation de l’agresseur. Il va réagir pour acheminer le plus rapidement possible, au bon endroit, tout son arsenal défensif, puis offensif.
I La réaction inflammatoire aigue.
A Définition.
La réaction inflammatoire est une réaction physiologique due à la présence d’un agresseur ou d’un traumatisme et qui met en jeu une accumulation localisée de cellules du système immunitaire. , au même titre que l’organisme réagit à l’exercice en augmentant les apports sanguins.
Cette réaction inflammatoire est le moyen de la défense immunitaire innée et l’étape de déclenchement de la réponse immunitaire spécifique.
Trois évènements caractérisent cette réaction inflammatoire:
- Augmentation de l’irrigation sanguine locale (rougeur plus chaleur),
- Augmentation de la perméabilité vasculaire, accompagnée du passage de plasma dans les tissus: provoque un gonflement, œdème et douleur,
- Afflux des leucocytes: polynucléaires, monocytes et lymphocytes. Il y a diapénèse des monocytes (traversée de la paroi). Ces cellules sont guidées dans leur déplacement par de nombreux signaux (gradient de facteurs chimiotactiques et augmentation des molécules d’adhérence).
B Mécanismes moléculaires et cellulaires.
Déclenchement de l’étape initiatrice.
Dans tous les cas, il y a des lésions tissulaires s’accompagnant de lésions vasculaires qui déclenchent la coagulation sanguine.
Le premier temps de la coagulation sanguine est dit «temps endothélio-thrombocytaire: il va y avoir attraction et activation des plaquettes au niveau des capillaires endommagés, ce qui prévient de l’hémorragie.
Le deuxième temps est le temps plasmatique. Il va y avoir activation en cascade de facteurs solubles contenus dans le sang (fonctionnement comparable au complément). Il y a activation de facteurs de contact (XI et XII), ce qui va activer des kinines.
Le facteur XII va activer une proenzyme plasmatique, la prékallicréine et la faire passer sous sa forme de kallicréine (forme active). C’est une protéase qui a comme substrat le kininogène qui sera clivé en deux substances (kallidine et badykine), deux petits peptides, qui provoquent une forte vasodilatation, ce qui accentue la vasodilatation due à l’histamine libérée par les plaquettes activées.
L’histamine provoque aussi une contraction des cellules endothéliales et des muscles lisses sous-épithéliaux: il y a augmentation de la perméabilité vasculaire.
La vasodilatation permet un ralentissement du flux sanguin et une accumulation de leucocytes circulants (surtout pour les polynucléaires neutrophiles). Ces polynucléaires vont ensuite traverser les vaisseaux et atteindre le site inflammatoire: c’est une extravasation.
Le processus s’amplifie rapidement à la suite de l’activation des facteurs du complément qui gagnent le tissu enflammé. Au contact de l’antigène, il va y avoir activation du complément par les voies et alterne et classique. Il y a donc opsonisation et augmente de la présence des anaphylatoxines. Celles-ci vont exercer localement un chimiotactisme à l’égard des leucocytes sanguins circulants (présentant des récepteurs adéquats) et vont activer les mastocytes et les polynucléaire basophiles.
Les leucocytes activés vont libérer des substances à forte activité inflammatoire (histamine et sérotonine) ainsi que des substances regroupées sous le nom de médiateurs lipidiques de l’inflammation.
Ces facteurs sont produits par une phospholipase membranaire qui libère un acide gras à longue chaîne (acide arachidonique, un C20) et un lysophospholipide qui donnera le PAF.
Avec l’acide arachidonique, on aura deux voies différentes:
- action de la cyclo-oxygénase qui fournira du thromboxanne et des prostaglandines;
- action d’une lipoxygénase qui formera des leucotriènes.
Remarque : L’aspirine va acétyler la cyclo-oxygénase et ainsi l’inactiver.
D’autres substances accroissent cette réaction. C’est par exemple le cas des produits de clivage du fibrinogène (dont les fibrinopeptides) et de la fibrine: il va y avoir augmentation de la perméabilité des vaisseaux mais aussi augmentation du chimiotactisme pour les polynucléaires neutrophiles.
Sous l’action de plasmine (qui dégradent la fibrine), il y a activation du complément: il y a augmentation de la concentration en produits actifs du complément.
A la fin de ces cascades, la perméabilité est maximale: on a alors des cellules sanguines et des substances plasmatiques à activité antimicrobienne qui s’accumulent des les zones inflammatoires (complément, anticorps, lactoferrine [complexe Fe] et céruléoplasmine [complexe Cu]).
Après l’action des macrophages tissulaires, et par la libération de cytokines inflammatoires (IL1, IL6, TNFa), il y a synthèse hépatique accrue de protéines inflammatoires de phase aigue.
Les produits synthétisés vont permettre le maintien de l’inflammation.
II Migrations leucocytaires et molécules de signalisation.
Dès les premiers instants de la réaction inflammatoire, les leucocytes circulants affluent en grand nombre au site inflammatoire sous l’effet et de l’intense vasodilatation et d’une signalisation par les cellules endothéliales endommagées.
Ces cellules «stoppent» la circulation sanguine et dirigent les leucocytes vers les tissus sous-endothéliaux enflammés.
Le passage trans-endothélial des leucocytes concerne dans un premier temps les polynucléaires neutrophiles, puis les macrophages et les lymphocytes B. La signalisation se fait selon deux types.
Premier type de signalisation.
Il y a signalisation par expression de molécules membranaires complémentaires appariées sur les cellules endothéliales et sur les leucocytes circulant: ce sont des molécules d’adhérence endothélio-leucocytaires.
Deuxième type de signalisation.
Ce second type met en jeu tout un «cocktail» de produits libérés au site inflammatoire, avec activité chimio-attractive sur les leucocytes circulants (substances bactériennes, chimiokines synthétisées par les cellules de l’hôte).
A Molécules d’adhérence leuco-endothéliales.
Ces molécules forment un ensemble de substances classées en quatre grandes familles: les intégrines qui agissent avec les molécules de la superfamille des Ig. On trouvera aussi les sélectines qui interagissent avec les sialoglycoprotéines.
1 Les intégrines.
Les intégrines sont des glycoprotéines membranaires, hétérodimériques (association de façon covalente d’une chaîne polypeptidique a et d’une ß).
Une dizaine de chaînes a ont été caractérisées, pareillement aux chaînes ß. On trouve environ 20 intégrines différentes car toutes les combinaisons n’existent pas.
La sous-unité a possède 3 à 4 sites de fixation d’ions bivalents qui stabilisent la fixation de la chaîne avec son ligand.
Deux groupes d’intégrines ont un rôle important dans la réaction inflammatoire.
a Les intégrines ß1.
Ces intégrines sont reconnues par CD29. Elles sont impliquées dans l’interaction des leucocytes activés aux protéines de la matrice extracellulaire (collagène, laminine et fibronectine).
α4ß1 : Protéine VLA (Very Late Antigene).
b Les intégrines ß2.
Ces intégrines sont reconnues par CD18. Elles s’associent à une chaîne a de trois types : CD11a, CD11b ou CD11c.
Le complexe CD18-CD11a a initialement été appelé LFA1. LFA1 est exprimé à niveau élevé sur les leucocytes, sur la membrane des lymphocytes T auxiliaires activés et va interagir avec les molécules de la superfamille des Ig (I-CAM 1, 2 ou 3).
Les I-CAM sont exprimées sur la membrane des CPAg et permettent de retenir les lymphocytes T auxiliaires sur les CPAg. Il va ainsi y avoir transduction des signaux d’activation des T auxiliaires.
CD18/CD11a forme le CDR3 du complément.
CD18/CD11c forme un récepteur de type 4.
Ces deux ensembles jouent un rôle primordiale dans le fonctionnement leucocytaire, comme le montre, chez certains individus, l’absence congénitale de chaîne ß2 (déficience de l’adhésion leucocytaire: LAD).
2 La superfamille des Ig.
Les molécules de cette famille sont transmembranaires, caractérisées par la présence de 2 à 5 domaines extracellulaires, homologues aux domaines de Ig.
Ces molécules interagissent avec les intégrines et cette superfamille comprend principalement des molécules d’adhésion intercellulaire (I-CAM1, 2 et 3). I-CAM1 et2 sont exprimées sur les cellules endothéliales (intactes ou activées). Les CPAg expriment aussi, généralement ces trois types d’I-CAM et vont agir avec l’intégrine LFA1, exprimée par les lymphocytes T.
La cellule endothéliale activée exprime une I-CAM appelée V-CAM, ayant pour ligand une intégrine exprimée par les leucocytes (VLA4).
Cette nomenclature est confuse car la découverte des molécules a été réalisée par diverses approches :
- approche structurale (avec des anticorps monoclonaux)
- ou par approche de test fonctionnels d’interaction entre cellules.
3 Les molécules apparentées à la mucine.
Dans ce groupe on retrouvera des sialoglycoprotéines (comportent une chaîne polypeptidique qui ancre ces molécules dans la membrane où se branchent de nombreuses chaînes glucidiques riches en acide sialique)
Ces molécules ont une expression constitutive ou induite. Elles peuvent être exprimées par presque toutes les cellules ou bien restreintes à des types cellulaires définis.
Par exemple, CD34 est exprimé sur toutes les cellules endothéliales alors que Gly-CAM1 et MadCAM1 montrent une expression restreinte à certains endothéliums.
Cly-CAM1 est exprimée sur les cellules endothéliales des HEV (Veinules à endothélium haut). Les HEV sont uniquement dans les organes lymphoïdes périphériques activés par la présence de l’antigène.
La Mad-CAM1 (Mad = Mucosal Adressin) est exprimée sur la membrane des cellules endothéliales constituants les capillaires des muqueuses (intestinales et bronchiques).
Ce type de molécule est impliqué dans la localisation préférentielle des lymphocytes mémoire, au niveau de certains tissus: ce type sert «d’adresse» pour ces lymphocytes mis en jeu.
Les leucocytes expriment sur leur membrane de nombreuses sialoglycoprotéines qui partagent des radicaux glucidiques, ce qui confère une spécificité antigénique, définissant un système de groupe appelé, le système Lewis. (on parlera de spécificité Sialyl Lewisx).
4 Les sélectines.
Les sélectines sont les ligands des sialoglycoprotéines. Ce sont des glycoprotéines transmembranaires caractérisées par une région amino-terminale (environ 130 acides aminés) avec une structure très proche de la région amino-terminale des lectines végétales liant les sucres (les C-lectines).
On trouve trois types de sélectines selon le type cellulaire les exprimant:
- Les L-sélectines : sont exprimées constitutivement sur les leucocytes (en quasi-totalité).
- Les E-sélectines : sont exprimées sir les cellules endothéliales activés et leur expression est induite par la libération de cytokines inflammatoires par les macrophages (IL1, IL6, TNFa).
- Les P-sélectines< : sont initialement trouvées dans les plaquettes. Elles y sont stockées à l’intérieur, dans des granules de sécrétion. Par activation plaquettaire, il va y avoir exocytose des granules et ces sélectines vont venir s’ancrer sur la membrane plaquettaire.
On trouvera également des granules dans les cellules endothéliales. Elles ont la même fonction que précédemment. Elles sont activées grâce à des substances solubles (leucotriènes, histamine, anaphylatoxine).
Les P-sélectines interagissent sur les sialoglycoprotéines.
B Les chimiokines.
Les chimiokines sont des protéines de faible poids moléculaire (environ 100 acides aminés). Toutes ces molécules sont caractérisées par la présence de 4 cystéines à des positions conservées (il y a formation de deux ponts di-sulfures). On a un pont entre les cystéines 1 et 3 et un autre entre les cystéines 2 et 4.
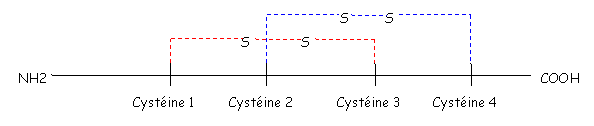
Selon la position relative des deux premières cystéines (soit contiguës, soit séparées), ces chimiokines seront classés en quatre groupes.
- Les CC Chimiokines: Cystéine 1 et 2 continues.
- Les CxC Chimiokines: Cystéine 1 et 2 séparées par un acide aminé.
- Les C Chimiokines: disparition de la cystéine 2.
- Les CxxxC Chimiokines (Cystéine 1 et 3 séparées par trois acides aminés).
Les chimiokines sont des protéines produites et sécrétées par les cellules endothéliales activées et par certains leucocytes, de manière constitutive pour le trafic leucocytaire et de manière induite pour la synthèse de cytokines inflammatoires servant au recrutement des leucocytes au site d’inflammation.
Exemples :
- MCP1,2,3 (CC): attirent les monocytes.
- MIP (CC): Macrophages inflammatory proteins.
- IL8 (CXC).
Les chimiokines réalisent leur effet par des récepteurs à 7 segments transmembranaires liés aux protéines G. L’interaction ligand récepteur n’est pas spécifique.
La fonction des chimiokines inductives est de signaler un conflit immunitaire spécialisé. Il y va avoir recrutement par deux mécanismes.
- Le chimiotactisme positif (pour les leucocytes possédant les récepteurs adéquats). L’IL8 attire et recrute les polynucléaires neutrophiles (seuls leucocytes à exprimer fortement le récepteur correspondant).
- Ces chimiokines modulent (n quantité et qualité) l’expression membranaire entre les leucocytes et l’endothélium.
C la migration transendothéliale (des neutrophiles).
Cette migration est généralement coupée en quatre parties.
1 L’étape de «roulement» des polynucléaires sur l’endothélium.
Les molécules d’adhérence cellulaire vont interagir entre elles (par de faibles interactions) et il va y avoir un ralentissement des leucocytes qui vont rouler sur l’endothélium.
2 L’activation.
Cette étape permet aux chimiokines, libérées par les cellules endommagées (ou par les fibroblastes) de faire une interaction avec certains domaines qui vont modeler positivement l’expression membranaire des intégrines leucocytaires.
Cela va induire un changement conformationnel de ces intégrines qui adoptent une nouvelle conformation ayant une forte affinité pour les molécules de la superfamille des Ig.
3 Etape d’arrêt.
Il y a à ce moment là, une forte adhérence des leucocytes à la paroi endothéliale.
4 Migration transendothéliale.
Un même processus permet aux lymphocytes B et T vierges (naïfs), de gagner les organes lymphoïdes secondaires, au niveau des HEV.
D La domiciliation des lymphocytes B et T mémoire (homing = écotaxis).
Depuis longtemps, on a vu que les lymphocytes B et T prélevés au niveau d’un organe lymphoïde donné et que l’on réinjecte dans la circulation sanguine d’un autre individu histocompatible (syngénique), vont se localiser dans les mêmes organes lymphoïdes que celui duquel ils sont issus.
Ils présentent une attirance pour un organe donné: c’est un processus reposant sur l’expression tissu/organe spécifique de certaines molécules d’adhérence enter lymphocytes B et T mémoire et les cellules endothéliales des HEV.
Exemples :
Cas des lymphocytes mémoire des plaques de Peyer de la muqueuse intestinale.
On trouve de nombreux lymphocytes B et T au niveau du derme de la peau chez les sujets à hypersensibilité retardée (cas de dermatite, d’eczéma allergique).
Les cellules endothéliales expriment une CAM particulière (Mad-CAM1) qui interagit avec une intégrine spécifiquement exprimée sur la membrane des lymphocytes B des plaques de Peyer : LPAM-1 (Lymphocyte Peyer Patch Adhesin Molecule) qui permet aux lymphocytes B et T d’être retenus.
Les lymphocytes B et T cutanés, dans le derme ont des sialoglycoprotéines (CLA) qui interagissent avec une sélectine (E-sélectine) des capillaires cutanés.
Les lymphocytes mémoire acquièrent une mémoire topographique partiellement codée par les molécules d’adhérence.
Il va donc y avoir une localisation de ces lymphocytes dans une région qui est plus probable de rencontre l’antigène.
