I Propriété fondamentale des gaz.
A Pression atmosphérique.
La pression atmosphérique correspond à la pression au niveau de la mer.760 mm Hg → 1013 hPa. Cette pression diminue avec une augmentation d’altitude.
B Pression partielle.
La pression partielle est la pression exercée par les molécules d’un gaz donné dans un mélange de gaz.Au niveau de la mer, on a :
- 21% d’O2 → PO2 = 158,8 mm Hg,
- 0,03% de CO2 → PCO2 = 0,23 mm Hg,
- 78,97% de N2 → PN2 = 601 mm Hg.
La diffusion des gaz respiratoires est effective seulement si les gradients de pression partielle en O2 et CO2 sont maintenus de part et d’autre de la surface d’échange. Ceci est possible grâce au renouvellement permanent du sang (par le cœur) et de l’air alvéolaire (par la ventilation).
Cette diffusion dépend de la solubilité des gaz dans un liquide.
A l’équilibre, la pression partielle d’un gaz est équivalente dans l’air ou dans l’eau.
Loi de Henry : la quantité de gaz qui se dissout dans un liquide est directement proportionnelle à la pression partielle du gaz et de son coefficient de solubilité (à température constante). Si la température augmente, la quantité de gaz dissout diminue.
Remarque : le CO2 est 23 fois plus soluble que l’oxygène.
II Le mélange gazeux moléculaire.
A L’air inspiré.
C’est un mélange en O2, CO2 et N2. Quand l’air arrive dans les voies respiratoires, il devient saturé en vapeur d’eau, ce qui entraîne une modification de la pression partielle de chacune des molécules de gaz.La pression intra-pleurale joue un rôle dans l’inspiration. Elle diminue pendant l’inspiration et permet à l’air de rentrer dans les poumons (elle augmente quand l’air est expiré).
B L’air alvéolaire.
Le sang s’équilibre avec l’air alvéolaire qui contient : 14% d’O2 (PO2=105mm Hg), 5,5% de CO2 (PCO2=40mm Hg).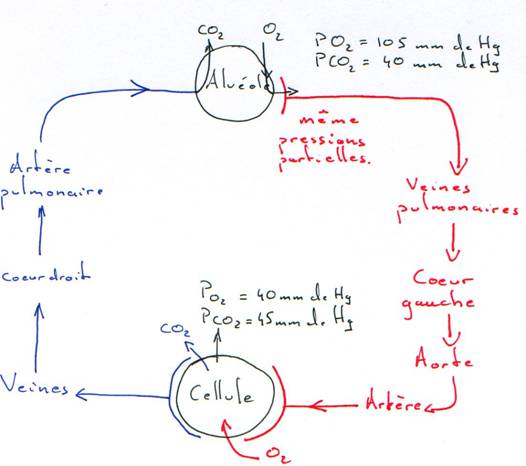
III Transport de l’oxygène.
A L’O2 dissout.
0,3 mL d’O2 est dissout pour 100 mL de sang. C’est insuffisant pour couvrir les besoins cellulaires (20 mL d’O2 sont nécessaires pour 100 mL de sang).B L’O2 combiné.
L’O2 se combine à l’hémoglobine de façon réversible en fonction de la pression partielle en O2 à un niveau donné.L’hémoglobine : C’est une protéine des hématies, constituée de quatre sous-unités, chacune formée d’une chaîne polypeptidique (la globine) à laquelle est fixé un hème (Fe2+) qui fixe l’O2. Chaque molécule d’hémoglobine peut fixer quatre molécules d’O2.
Quand l’O2 est fixé, on parle d’oxyhémoglobine.
On a à peu près 15g d’hémoglobine pour 100mL de sang et 1g d’hémoglobine fixe 1,39mL d’O2.
La pression partielle en O2 est le principal facteur de fixation de l’O2. L’affinité de l’hémoglobine est élevée au niveau alvéolaire pour l’O2 : on parle d’hémoglobine saturée (à 90%).
Au niveau cellulaire, le pourcentage de saturation est de 75% : il y aura, à ce niveau, libération d’O2 plus facile pour qu’il puisse rentrer dans la cellule.
Le 2,3 diphosphoglycérate est un glucide produit par les hématies.
IV Transport du CO2.
A Le CO2 dissout.
2,5 à 3mL de CO2 sont dissous pour 100mL de sang. Un litre de sang contient 500mL de CO2. Ce type de transport représente 10% du total de CO2 transporté.B Transport combiné du CO2.
Le CO2 peut se combiner à l’eau et donner de l’acide carbonique.CO2 + H2O <-> H2CO3 <-> HCO3- + H-.
Dans les hématies, on a une enzyme, l’anhydrase carbonique, qui accélère la formation des ions HCO3-. Ces ions vont diffuser dans le plasma en faisant rentrer des ions Cl- dans les hématies. è 60% du CO2 est transporté sous cette forme.
Combinaison avec l’hémoglobine.
L’hémoglobine peut fixer et libérer le CO2 au niveau des globines, on parle alors de carbamino-hémoglobine.
Au niveau des tissus, la libération de CO2 entraîne une diminution du pH qui tend à dissocier l’O2 de l’hémoglobine.
La libération d’un proton donne une recombinaison de HCO3- puis une dissociation en H2O + CO2 qui sera évacué.
Chapitre suivant:
