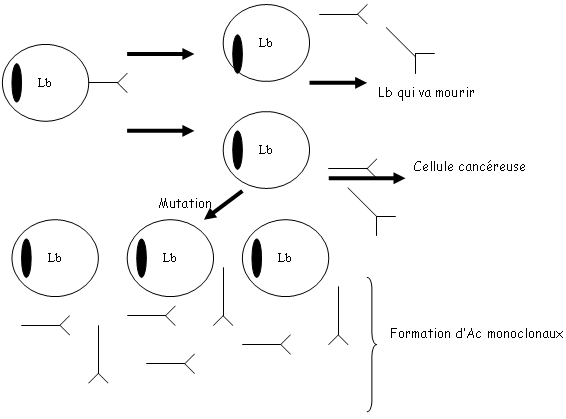
I Les Ac monoclonaux.
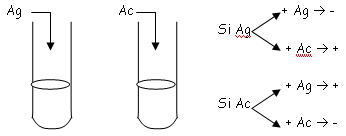
L’adjuvant de Freund :On récupère ces Lb qui donnent un Ac monoclonal. On va ensuite injecter dans une souris la protéine X d’un myélum. On récupérera ensuite la rate et les ganglions. On va obtenir des Lb dont on va faire fusionner les membranes grâce à du PolyEthylènGlycol.
On obtient alors un hybridome à qui l’on va faire subir une dilution limitée. Après cette phase, on récupère les Lb et les cellules hybrides. On les place ensuite dans trois milieux différents :
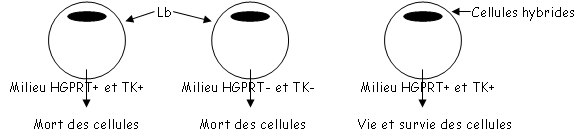
Le mélange contient de l’aminoptérine, de l’hypoxanthine et de la thymidine : on appelle ce milieu, un milieu HAT.
On place les Ac récupérés dans des puits et après vérification, on a toujours un Ac monoclonal.
II La réaction secondaire Ag/Ac.
A L’immunoprécipitation.
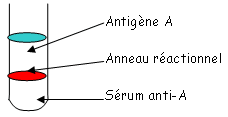
On a deux types de précipités AgAc :- Selon l’aspect qualitatif (présence ou non d’Ag, d’Ac). Si on a suffisamment de précipité, on a la reconnaissance de l’Ag. C’est une réaction rapide (quelques minutes). Il faut toutefois une bonne quantité de sérum.
- Aspect quantitatif : c’est un phénomène de zone. Cet aspect est étudié depuis 1933 par Heidelberg. On étudie les différences entre les concentrations en Ag et en Ac. On fixe l’anti-sérum (quantité fixe) et on fait varier la quantité d’Ag.
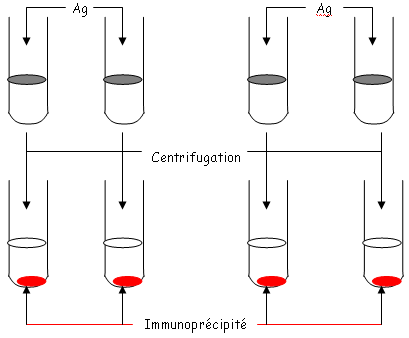
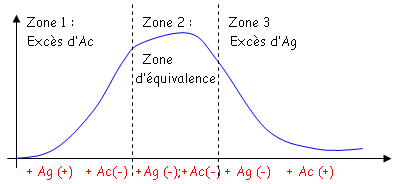
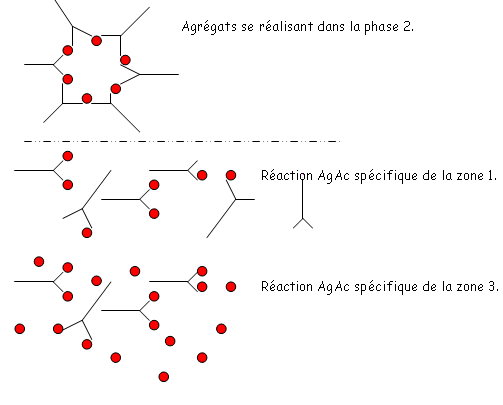
- Zone 1 : on réalise une augmentation progressive de la concentration en Ag.
- Zone 2 : c’est une zone de stabilité.
- Zone 3 : quand il a trop d’Ag, on a une diminution de la quantité d’immunoprécipité.
B Immunoprécipitation en milieu gélifié.
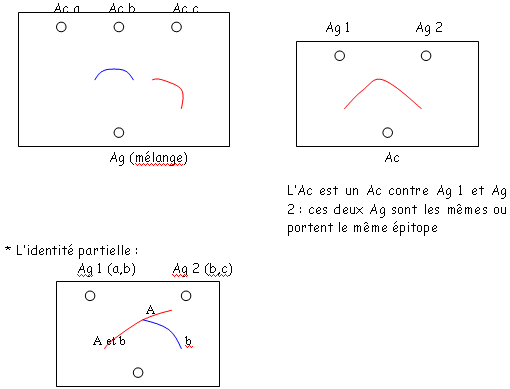
On peut voir la réaction AgAc grâce à des dépôts de ces deux produits. On les place dans des puits et on les laisse se diffuser dans le milieu où ils se diluent. Quand ils se rencontrent, on voit les précipités au niveau de leur lieu de formation (les précipités ont lieu quand les deux produits sont en concentration adéquats : zone d’équivalence). Evidemment, ces arcs apparaissent quand l’Ac reconnaît l’Ag.Il existe plusieurs types de diffusion :
- Réaction à diffusion simple : un seul des deux éléments diffuse.
- Réaction à diffusion double : les deux diffusent.
- Technique à diffusion unidimensionnelle.
- Technique à diffusion bidimensionnelle.
C Immunocytolyse.
La lyse est réalisée par les molécules du complément (protéines du sérum ; de C1 à C9). Leur fixation sur l’Ac est réalisée une fois que cet Ac s’est fixé sur l’Ag. Le complément se fixe sur la partie Fc des IgG seulement : c’est la voie classique d’activation du complément. La lyse réalisée est dite «lyse complément dépendante de l’Ag ».La voie alterne est indépendante des Ac. Le complément est activé par des morceaux de l’Ag et entraîne sa lyse.
La technique de fixation du complément (de déviation du complément) est peu utilisée mais quand même… Cette méthode sert à détecter un Ac contre un Ag précis dans un sérum. On l’utilise dans le cas des maladies hémolytiques des bébés (problème Rh+, Rh-). Quand le sang du bébé passe dans le sang de la mère (si celle-ci n’a pas le même rhésus ; dans ce cas, elle est Rh-) qui va développer des Ac anti-Rh+. Ces Ac vont passer le placenta et aller détruire les hématies du bébé au lieu de protéger ce dernier. Cette méthode est alors utilisée pour détecter les Ac indésirables.
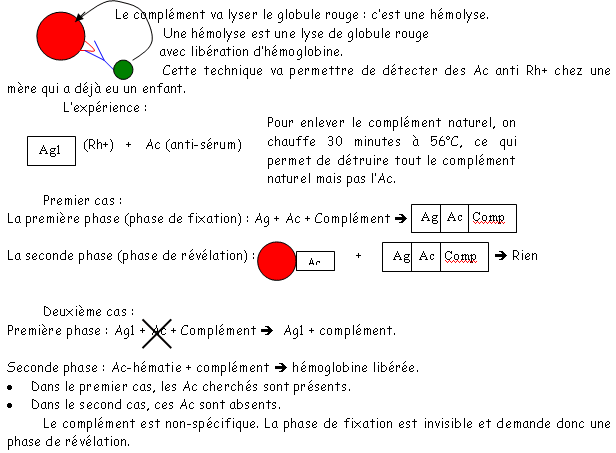
D Immuno-agglutination.
Cette technique rejoint la méthode de précipitation et de cytolyse : c’est une agglutination de particules qui est le résultat d’une réaction d’Ac dirigés contre des Ag portés par cette particule. Le résultat est visible à l’œil nu.
Pour réaliser celui-ci, il faut diminuer les forces électrostatiques de répulsion entre cellules. Si les cellules sont dans un milieu salin à pH=7 (électriquement neutre), les cations se positionnent autour de la cellule et donne le potentiel ζ qui sera ici un potentiel de cations. On peut changer le potentiel salin : s’il y a moins de cations, les cellules se rapprochent. On peut changer le pH, la viscosité du milieu. Pour avoir une bonne agglutination, il faut diminuer ζ pour augmenter la force ionique du milieu. Pour cela, on ajoute du NaCl et on utilise des tampons avec une grande force ionique.
Les différents types d’agglutinations : les particules utilisées sont souvent des cellules avec des Ag appartenant naturellement à leur membrane (par exemple, les globules rouges avec comme Ag les marqueurs du groupe sanguin). Les cellules utilisées sont souvent des hématies et des bactéries. C’est une recherche à l’envers : on connaît l’Ag et on cherche l’Ac.
1 L’agglutination directe (l’Ag est naturellement porté par la particule).
On se place dans un milieu salin (NaCl à 9 pour mille). Les Ac mesurés sont des IgM car celles-ci sont pentamériques et permettent donc de plus gros agglutinats. Ces IgM sont chargées négativement et vont attirer les cellules positivement chargées.On se sert de l’agglutination directe pour la recherche des groupes sanguins.
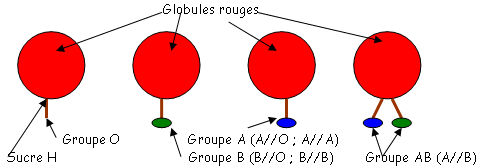
2 Agglutination artificielle (ou indirect).
On a des IgG (qui ont deux sites de fixation, donc une moins grande capacité pour la formation d’un réseau) et des de répulsion importante entre cellules. On va donc utiliser des artifices pour diminuer les forces de répulsion et donc, augmenter le réseau.On utilise de la papaïne pour couper de nombreuses protéines situées à la surface des membranes de globules rouges : on a une diminution des forces de répulsion.
On ajoute des macromolécules qui par leur taille, vont encore diminuer ces forces de répulsion.
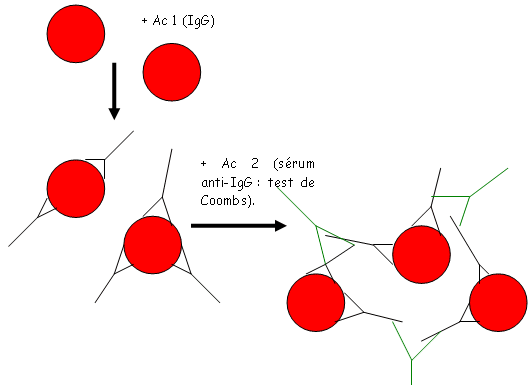
On ajoutera ensuite, dans le sérum, des Ig anti-IgG afin d’augmenter la taille du réseau.
Le test de Coombs sert à rechercher des IgG, obtenues par allo ou auto-immunisation, dans un sérum. On met des hématies dans du sérum physiologique et on essai de détecter les IgG (on se met en conditions salines pour ne pas encore avoir la formation du réseau). On ajoute alors les anti-IgG et on aura alors un possible réseau.
3 Immuno-agglutination directe.
4 Immuno-agglutination indirecte.
C’est une recherche par des Ig de molécules non naturelles sur un globule rouge (par exemple, le latex se fixe très bien). On se sert de cette méthode pour rechercher des IgG libres.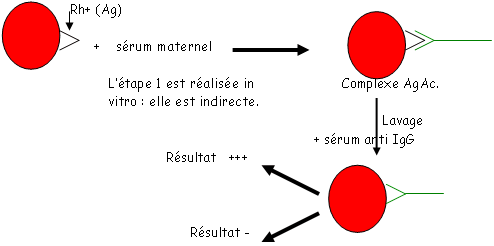
5 L’agglutination passive.
La particule ne possède pas naturellement l’Ag : on lui fait subir une greffe chimique (remarque : cette méthode est utile pour tester un Ag soluble). L’immuno-agglutination est beaucoup plus sensible que l’immunoprécipitation.La particule n’est pas directement impliquée dans l’agglutination. Avec cette technique, on dose les facteurs rhumatoïdiques (anti IgM ou G) qui sont dans le liquide synovial des gens atteints d’arthrite.
III La réaction primaire AgAc.
A L’immuno-fluorescence.
On a une visualisation de la réponse grâce à un fluorochrome. Les fluorochromes sont des substances qui, quand elles sont soumises à un rayon lumineux, deviennent instables (passent à un état excité) et qui, pour revenir à l’état fondamental, émettent une longueur d’onde différente de la longueur d’onde absorbée (λ émise > λ absorbée).L’isothiocyanate de fluoriscine (ou FITC) absorbe à λ=490nm et émet à λ=517nm (vert).
L’isothiocyanate de rhodamine absorbe à λ=550nm et émet à λ=580nm (rouge, orangé).
La phycoérythrine est un autre fluorochrome.
La lecture est réalisée avec un microscope à fluorescence.
1 Immuno-fluorescence directe.
Le fluorochrome est fixé à l’Ac qui reconnaît l’Ag que l’on veut trouver.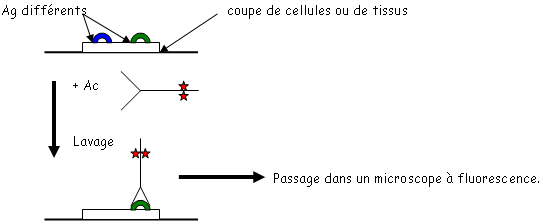
2 Immuno-fluorescence indirecte.
1ère réaction : avec un Ac1 spécifique à l’Ag mais non marqué.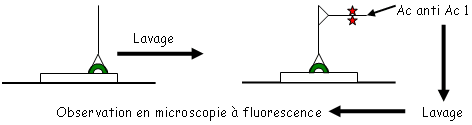
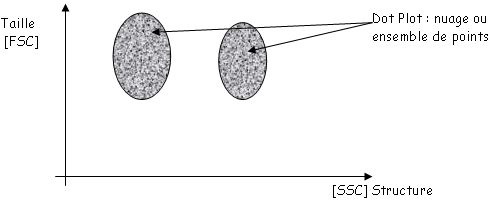
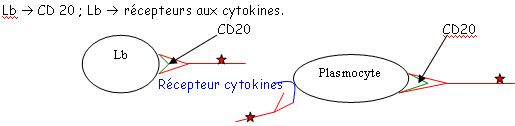
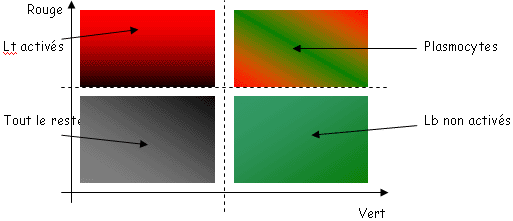
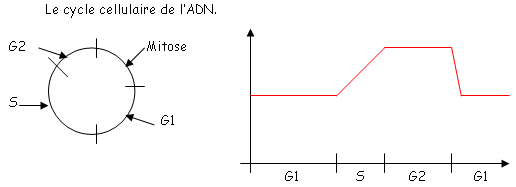
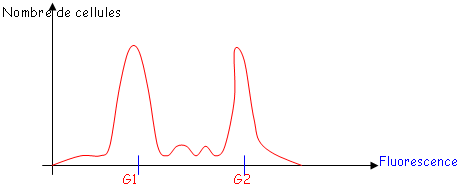
B Cytométrie de flux.
La cytométrie de flux est une méthode fiable de comptage de cellules vivantes.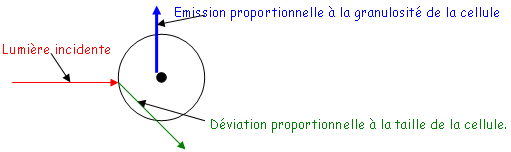

C Technique immuno-enzymatique.
Réaction principale : Substrat (lame) → Substrat coloré grâce à une réaction enzymatique.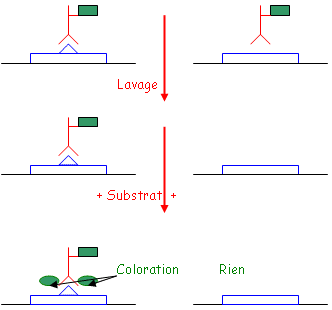
1 Elisa non compétitif direct.
2 Elisa non compétitif indirect (Elisa sandwich).
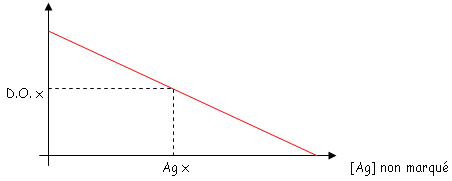
3 Elisa compétitive (méthode plus sensible que les compétitives).
- Pas de coloration, donc pas de réaction enzymatique : les Ac n’ont reconnu que les Ag provenant de la phase liquide.
- Il y a une coloration, donc une réaction enzymatique : les Ac ont reconnu les Ag liquides et ceux de la phase solide.
- La fixation des Ag est réalisée sur une plaque spécialement traitée pour fixer les protéines. Cette fixation est en général réalisée par un tampon basique.
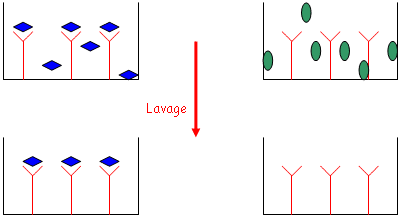
- Les étapes de lavage sont effectuées avec des tampons contenant des détergeants doux qui permettent de retirer tout ce qui est fixé de manière non-spécifique. Pendant le lavage, on ajoute des protéines de saturation.
- Le conjugué : c’est un complexe entre un Ac ou un Ag et une enzyme. On utilise la péroxydase du radis (raifort) → H2O2 → H2O + ½O2. La phosphatase alcaline qui enlève les protéines si elle est en milieu basique. Ces enzymes sont fixées de manière covalente grâce au glutaraldéhyde qui forme un pont entre l’enzyme et l’Ac ou l’Ag. Quand on doit fixer des sucres, on utilise le périodate de sodium.