Cette étude sommaire portera sur la segmentation et la gastrulation de l’embryon de drosophile (fig. 29, 30).
Segmentation et formation du blastoderme
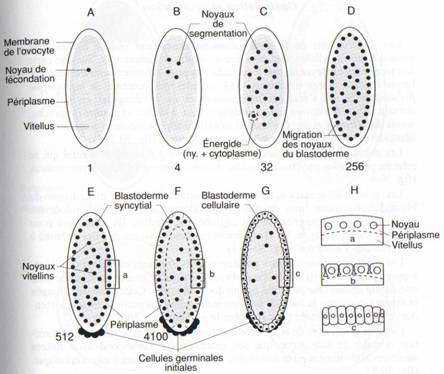
(fig. 29)La segmentation de l’œuf d’Insecte, centrolécithe, est une segmentation superficielle.
A la fin de la vitellogenèse, l’ovocyte est entouré de la membrane vitelline, très fine, et d’une seconde enveloppe plus externe et plus dure, le chorion, sécrétée par les cellules folliculeuses et pourvue d’une ouverture apicale ou micropyle, par où pénètrent les spermatozoïdes contenus dans la spermathèque1, lorsque l’ovocyte passe devant l’ouverture de celle-ci au moment de la ponte.
Après l’amphimixie, le noyau de fécondation situé dans la masse vitelline se divise rapidement, l’embryon comprend 128 énergides, (c’est-à-dire noyau environné d’un domaine cytoplasmique. sans membrane limitante), 72 minutes après la ponte. Après un cycle de divisions supplémentaires (256 énergides), celles-ci gagnent la périphérie de l’œuf où les noyaux continuent à se multiplier, mais plus lentement. Il se forme un blastoderme syncytial. Lorsqu’il y a 512 noyaux, les cellules polaires sont individualisées. Elles sont à l’origine des cellules germinales initiales. Les membranes plasmiques isolant les cellules du blastoderme se forment par invagination de la membrane de l’œuf ; chaque noyau entouré de son domaine cytoplasmique est isolé et, 3 heures plus tard, un blastoderme cellulaire, comprenant environ 6 000 cellules, est formé autour d’une masse centrale de vitellus contenant quelques noyaux vitellins, polyploïdes. Treize cycles cellulaires se sont succédé depuis la fécondation.
Dans le blastoderme syncytial, des différences apparaissent déjà parmi les noyaux quant à la durée de leurs cycles mitotiques et ceux-ci deviennent asynchrones tandis que la transcription d’ARNm augmente. Cette augmentation s’accélère après le 14ème cycle cellulaire. C’est alors que, les cellules devenant mobiles, la gastrulation commence.
1. L’appareil génital femelle des Insectes comporte une poche, la spermathèque (fig. 19), où sont conservés les spermatozoïdes après la fécondation, pendant des durées qui peuvent être assez longues.
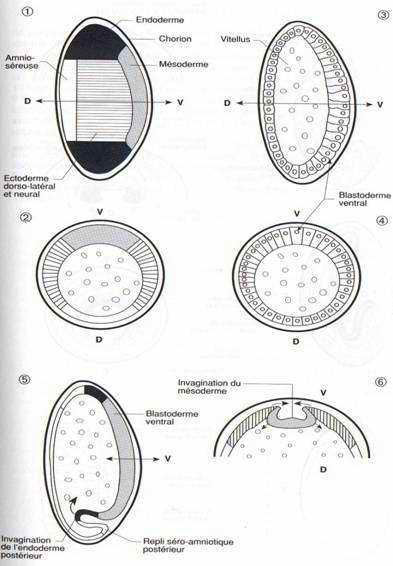
Gastrulation et neurulation
(fig. 30)Les mouvements de la gastrulation ne concernent que le blastoderme ventral dont les cellules sont plus hautes et plus volumineuses. Sur une carte des territoires embryonnaires, à ce stade, on peut délimiter ventralement une bande médiane large d’environ 1000 cellules qui constitue le mésoderme présomptif et, en s’écartant latéralement et en se dirigeant en direction dorsale, deux territoires ectodermiques, l’un à droite et l’autre à gauche, suivis de l’amnios et de la séreuse. Les extrémités antérieure et postérieure du blastoderme sont formées d’endoderme présomptif.(fig. 30-1, 2)
Les cellules mésodermiques s’invaginent le long d’un sillon ventral qui se referme pour isoler une ébauche aplatie de mésoderme sous l’ectoderme ventral. (fig. 30-6)
Une double invagination, à l’avant et à l’arrière du sillon d’invagination du blastoderme ventral, met en place l’endoderme antérieur et l’endoderme postérieur qui se rejoignent et qui englobent le vitellus. Ils fusionnent pour former l’intestin moyen. Ce mouvement entraîne aussi les cellules polaires à l’intérieur de l’embryon. (fig. 30-5, 7)
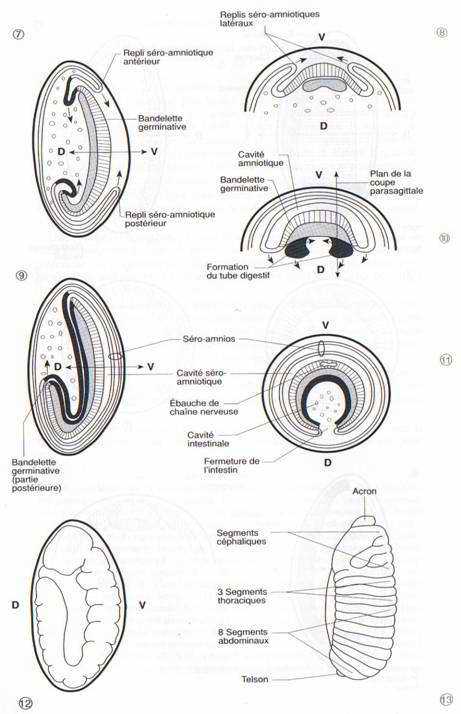
Les replis séro-amniotiques postérieurs, puis antérieurs et latéraux se développent pour recouvrir l’ébauche embryonnaire qui se trouve ainsi isolée dans une cavité amniotique protégée par un double feuillet. Cette ébauche allongée et épaisse constitue la bandelette germinative dont les parois latérales s’étendent en direction dorsale pour englober le vitellus. (fig. 30-8, 10)
La partie postérieure de la bandelette germinative croît et se retrousse en direction dorsale, de telle façon que son extrémité qui correspond à de futures structures abdominales, se trouve repliée au-dessus de la future région céphalique. (fig. 30-9)
La chaîne nerveuse se différencie dans le feuillet ectodermique, sous la forme de deux bandes de cellules qui se condenseront pour former une paire de ganglions par segment ; les ganglions de la région céphalique fusionnent ensuite en ganglions cérébroïdes. (fig. 30-11)
L’embryon se contracte dans le sens antéro-postérieur, et le repli en position dorsale de la partie abdominale disparaît. La division du corps en segments ou métamères devient visible. Sur une larve de 10 heures, on distingue 6 segments céphaliques, 3 segments thoraciques, 9 segments abdominaux (le nombre primitif de 13 abdominaux a été réduit ou modifié chez la drosophile). Les régions apicales de l’animal, l’acron en avant du premier métamère et le telson en arrière du dernier ne sont pas des métamères.
On verra plus loin que les mécanismes de régulation génétique qui déterminent la nature céphalique, thoracique ou abdominale d’un métamère chez un Insecte présentent de remarquables similitudes avec ceux qui contrôlent la différenciation des métamères suivant l’axe antéro-postérieur de tous les animaux métamérisés et notamment les Vertébrés.